
Pesquisa da farmacêutica Taís Gratieri da USP abre caminho para um
tratamento mais eficaz da ceratite fúngica, uma infecção na córnea
causada por fungos e que pode levar à cegueira. O estudo desenvolveu um
antifúngico em formulação líquida que, após a aplicação, se geleifica. O
material possui uma propriedade chamada de mucoadesiva que também
favorece a retenção da fórmula no olho. Dessa forma, uma maior
quantidade de antifúngico chegaria aos tecidos infectados.
Nos países em desenvolvimento, segundo Eduardo Melani Rocha, da
Faculdade de Medicina de Ribeirão Preto (FMRP) da USP, a ceratite
fúngica atinge 9 pessoas por milhão de habitantes e está diretamente
vinculada à atividade agrícola (ver abaixo). Segundo especialistas, não
existe tratamento eficaz para a ceratite fúngica, uma vez que o próprio
mecanismo de proteção dos olhos, como piscar e lacrimejar, elimina
rapidamente os colírios convencionais, fazendo com que o medicamento não
chegue aos tecidos infectados em quantidade suficiente.
Para o professor, o trabalho desenvolvido na FCFRP pode abrir
caminho para formulações específicas para o uso em infecção ocular e
assim atender adequadamente as pessoas com infecção fúngica nos olhos,
pois não existe produto desse tipo no mercado.
Os testes de permeação, ou seja, os testes realizados para se
determinar o quanto de antifúngico chegaria aos tecidos infectados,
foram feitos em córneas retiradas de porcos e em coelhos vivos. Já os
testes de retenção feitos para se verificar quanto tempo a solução
permanece no olho foi feito em humanos saudáveis, por isso, sem o
antifúngico.
Ceratite fúngica no Brasil
Estudo realizado por pesquisadores da Faculdade de Medicina de
Ribeirão Preto (FMRP) da USP, revelou que a incidência da ceratite
fúngica no Brasil é maior nos meses de seca, em homens com atividade
agrícola, sugerindo que a doença está relacionada à atividade agrícola
extensiva, ou seja, ao corte e colheita de cana de açúcar, laranja e
café.
O objetivo do estudo, segundo Eduardo Melani Rocha, do Departamento
de Oftalmologia e Otorrinolaringologia, foi chamar a atenção para o
problema e ao identificar os fatores de risco, propor medidas
preventivas. "A ceratite fúngica é uma doença grave, com alto risco de
levar a cegueira do olho acometido e atinge principalmente pacientes de
baixa renda, muitas vezes sem proteção adequada no exercício do
trabalho. Além disso, não existem remédios específicos aprovados para o
seu tratamento. São usados remédios aprovados para outras doenças
fúngicas, adaptados para o uso ocular."
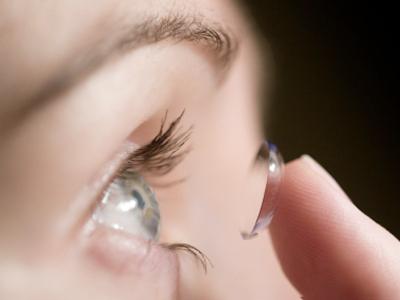
Dados
da literatura médica indicam que a doença atinge de 0,3 a 0,5 pessoas
por milhão de habitantes em países desenvolvidos e 9 pessoas por milhão
de habitantes, em países em desenvolvimento. "No Brasil a maioria dos
pacientes é de trabalhadores que sofrem acidentes oculares superficiais,
durante a atividade laboral, principalmente com vegetais. Em países com
predomínio de agricultura de subsistência, a estação úmida, as monções
na Ásia e África, por exemplo, também têm a maior incidência. Já nos
países desenvolvidos ela é predominante naqueles que fazem mal uso de
lentes de contato", diz o professor.
Imagem: Pedro Bolle / USP Imagens
Fonte:
Rosemeire Soares Talamone –
imprensa.rp@usp.br






 Dados
da literatura médica indicam que a doença atinge de 0,3 a 0,5 pessoas
por milhão de habitantes em países desenvolvidos e 9 pessoas por milhão
de habitantes, em países em desenvolvimento. "No Brasil a maioria dos
pacientes é de trabalhadores que sofrem acidentes oculares superficiais,
durante a atividade laboral, principalmente com vegetais. Em países com
predomínio de agricultura de subsistência, a estação úmida, as monções
na Ásia e África, por exemplo, também têm a maior incidência. Já nos
países desenvolvidos ela é predominante naqueles que fazem mal uso de
lentes de contato", diz o professor.
Dados
da literatura médica indicam que a doença atinge de 0,3 a 0,5 pessoas
por milhão de habitantes em países desenvolvidos e 9 pessoas por milhão
de habitantes, em países em desenvolvimento. "No Brasil a maioria dos
pacientes é de trabalhadores que sofrem acidentes oculares superficiais,
durante a atividade laboral, principalmente com vegetais. Em países com
predomínio de agricultura de subsistência, a estação úmida, as monções
na Ásia e África, por exemplo, também têm a maior incidência. Já nos
países desenvolvidos ela é predominante naqueles que fazem mal uso de
lentes de contato", diz o professor.

